- HOME
- 製品・サービス
- 酵素法による食品分析試薬 F-キット
- F-キットのアプリケーションノート
- 第2回 酵素はどんなものか(その2)-1/2
第2回 酵素はどんなものか(その2)-1/2
第2回 酵素はどんなものか(その2) page1
3.酵素の構造(その2)
前ページで、酵素の形はおおよそ球形をしているとご説明しました。
では、酵素はどのようにして触媒作用を働かせるのでしょうか。
そのところを直接目で見てみたいと思うのが人情です。
幸いにしていくつかの酵素の実際の形が解明されています。
一例としてリゾチームという酵素の形がわかっています。
この酵素は多糖類中のN-アセチルノイラミニン酸のβ-1,4結合の加水分解を触媒する働きをもち、
グラム陽性菌の細胞壁を破壊します。
鼻腔の粘膜や卵白にあって細菌からの感染を防ぐ大切な役目をしています。
この酵素の大きさは分子量14,500で、酵素としてはリボヌクレアーゼ同様非常に小さい部類に入ります。
大きさにすると45×30×30Å(オングストロームは長さの単位で1億分の1cm)です。
光学顕微鏡で見られる細菌の大きさが約10,000Åですからその数百分の1で、
電子顕微鏡を使っても全体の形がおぼろげに見える程度なのです。
酵素分子の詳しい形を知るためにはX線回折という方法を使います。
精製したリゾチームの溶液から注意深く時間をかけてリゾチームの結晶を作り出します。
この結晶にX線を当てるとX線が散乱しますが、結晶の規則性にしたがって特定の散乱像が得られます。
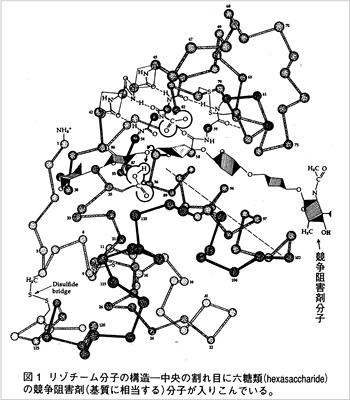
この散乱点と強さを解析して図1に示す分子モデルを描くことが出来るのです。
酵素分子の中央に基質を引き込む深い割れ目が見られます。
酵素と基質が結合した遷移状態にある中間体を取り出して直接目で見たいのですが、
残念ながら酵素‐基質複合体は非常に不安定なので取り出すことはできません。
その代わり、リゾチームの場合は幸いにして、基質と構造のよく似た競争阻害剤がいくつか知られており、
その中から、リゾチームと安定な複合体(酵素‐阻害剤複合体)を作る物が得られ、
その複合体の立体構造が解明されました。
図1にはリゾチーム分子の活性中心の割れ目の中に基質(あるいは拮抗阻害剤)の糖鎖が入り込む様子が
示されています。
割れ目部分が酵素の活性中心に相当し、ここに入った
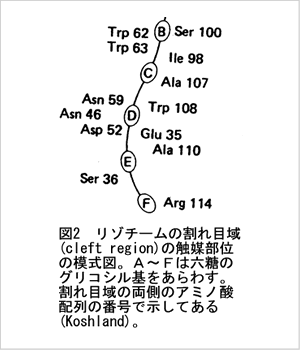
基質分子との位置関係を示したのが図2です。
リゾチーム分子の割れ目に6残基の糖鎖がはめ込まれ、
活性部位を形作る周りのアミノ酸残基と接触する
様子が覗えます。
リゾチームの例以外でも、リボヌクレアーゼやトリプシン
など、多くの酵素分子に触媒活性を示す割れ目や
くぼみ(活性部位、活性中心)があり、基質がその中に
取り込まれることがわかっています。
酵素が特異的に基質と反応する機構を説明する
いろいろなモデルが提唱されてきました。
100年以上前にドイツのフィッシャーが「鍵と鍵穴」説
を提唱していました。
基質と酵素の活性部位との関係は鍵と鍵穴の関係に
あり、分子の構造が鍵穴にうまく適合する物質のみが
基質として反応するという説です。
つまり、上のリゾチームの例からも見られるように
この古典的な説が大筋においては正しかったこと
がわかります。
基質はなぜ酵素の活性部位の割れ目やポケットに入るのでしょうか。
リゾチームの例(図2)からもわかるように、酵素の活性部位の表面にはいくつかのアミノ酸残基の側鎖が露出しています。
これらの側鎖と基質分子との間で、水素結合、イオン結合、疎水結合と、それぞれの足し合わされた力で
引き合うことによって起こると考えられます。
この点は酵素分子の立体構造の形成時にペプチド鎖が折り畳まれる状況と同様です。
酵素の動的柔構造と触媒作用のメカニズム
酵素が基質特異性を示すのは鍵と鍵穴の関係によって活性中心に合致する化合物だけを選択的に引き込むこと
によるのであろうと述べました。
図2に示したリゾチームの例では基質の入る割れ目は両側の14個のアミノ酸残基で囲まれています。
このうち直接的に糖鎖の切断に関与する触媒基はAsp52 とGlu35で、糖残基のDとEの間で切るということ
がわかっています。
つまり活性中心といわれる部位をさらに詳細に見ると、基質を見分けて結合し固定する部位と、
触媒作用を表す部位の2つの機能に分けて考えることが出来ます。
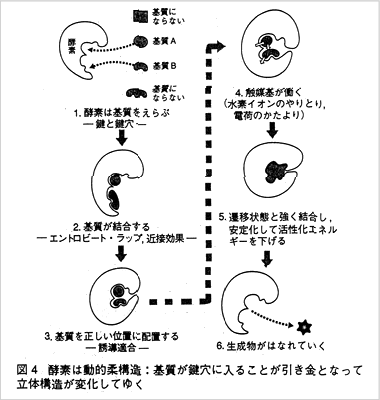
では鍵が鍵穴に入った後どうなるのでしょうか。
鍵穴に相当する酵素分子の側は鉄製の錠前のように硬いものではなく柔軟性に富んだものとして理解する
必要があります。
触媒作用を正確に説明すると余りに専門的になりすぎ、またまだ十分解明されていない点も多いので
イメージ的な話にとどめて置きます。
- 1)基質分子が酵素分子の結合部位に結合します。
- 2)基質分子が結合したというシグナルが伝わり酵素分子の立体構造に変化が起って、
触媒作用を進めるのにちょうどよい位置に触媒基が配置されます。酵素分子の立体構造が変化することにより、
一方の基質分子の側も歪みやゆがみを受けます。
ここで、なぜ酵素分子は通常基質分子より大きいのかが、わかりますね。
いわばコブラツイストをかけるには巨漢のプロレスラーの方がわざの効きがよい
のと似ています。この結果として基質分子の反応する部分と、酵素の触媒基とが接近し接触するようになります。 - 3)基質分子が触媒基と反応して「酵素‐反応中間体」を作ります。
この反応中間体は前回で述べた白金触媒の例に照らすと、H2分子、O2分子が白金表面上で
「遷移状態」になることに相当します。
「反応中間体」の具体例として、セリン型たんぱく分解酵素での例がよく知られています。
基質であるペプチド鎖が加水分解される過程で、酵素の触媒基と不安定ながら共有結合で結合し、
複合体を作るのです。
トリプシン、キモトリプシン、エラスターゼなどではいずれも触媒基がセリン残基であり、
セリン側鎖の-OHが図3に示すように基質と反応中間体を作ります。
セリンのHが出てペプチド鎖を切って生じたN端のアミノ基に入り、他方のC端の-COは
セリン残基につながり「アシル‐酵素中間体」を作ります。 - 4)このアシル‐酵素中間体は不安定で、すぐ加水分解されてセリン残基に戻り、
アシル‐の方は遊離酸(つまり生成物)として酵素から離れてゆきます。
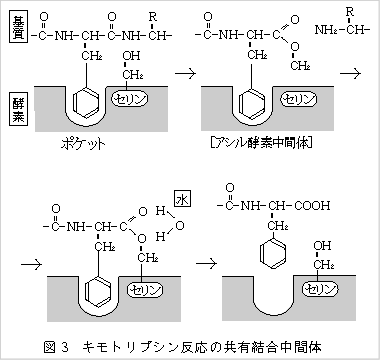
以上が酵素の触媒作用の大まかなイメージで、イラスト(図4)のようになります。
ポイントは基質が酵素の触媒基と反応中間体を作る点です。
ただ多くの酵素では、反応中間体は必ずしも上例の「アシル-酵素中間体」のように実体が明確なものではなく、
むしろきわめて不安定で検出できないほど瞬間的にしか存在しないことの方が多いのです。
また酵素によって反応中間体は一つではなく、数ステップの反応中間体を順次経過して変化してゆく、
と考えられます。つまり移りゆく「遷移状態」と呼ばれるゆえんです。
反応中間体として酵素に結合しているのは正確に言うと、もはや基質ではなく基質が変化したもので、
生成物になる前のものです。
たんぱく分解酵素は全てセリン残基を触媒基にしている訳ではありません。
各種の酵素の活性中心を調べてみると、触媒基となるものとしてはヒスチジンの側鎖が多く、
システインの-SH基、グルタミンの-NH2、アスパラギン酸残基の-COOHなどが見られますが、
いずれもH原子の授受をする基です。
多くの化学反応では、強酸や強アルカリを用いて苛酷な条件下で反応を進めることが多いのに、
酵素反応では中性付近でうまく進む不思議さを前回に述べました。
この秘密は、酵素の活性中心にあるこれらの触媒基がH原子やH+の出し入れをしていること
(つまり酸・アルカリとして働いていること)にあるのです。
酵素の分子上のある限られた部分のみが一時的に酸性またはアルカリ性になった、と考える事もできます。
さらに触媒反応をエネルギーの視点で見ると:
前回に、化学反応が進むためには活性化エネルギーの障壁を越えることが必要で、
酵素の役割はこの活性化エネルギーという障壁の山を低くすることであると言いました。(前回の図2を参照)
では上で述べた酵素の触媒作用のメカニズムのステップは活性化エネルギーの山を
低くすることとどう関係するのでしょうか。
酵素がないとき(化学反応では)、反応物の濃度を上げ、熱をかけて山を一気に駆け上がらねばなりませんが、
酵素があれば山の途中で一休みしながら迂回路を通ってゆくことができると言いました。
一休みしながらの迂回路とは、基質と酵素の結合であり、基質の構造の歪みであり、
「酵素‐反応物中間体」の形成に相当します。
活性中心の中で遷移状態を経ることは、つまり山の途中で迂回路に入り、脇道から低い峠を越えることに相当します。
高い活性化エネルギーの頂を登ることなく、楽に通り抜けることができるのです。
執筆者:深見 博一(理学博士)
本書で引用した図表の出典
図1:D. E. Metzler, Biochemistry, Academic Press Inc., 1977
図2:R. K. Murray et al., Harper’s Biochemistry 21st ed., Appleton & Lange, 1988
図4:藤本大三郎, 酵素反応のしくみ,(株)講談社ブルーバックス, 2001. 12. 01.
資料ダウンロード
上記の内容をPDFでダウンロードできます。
|