- HOME
- 製品・サービス
- 酵素法による食品分析試薬 F-キット
- F-キットのアプリケーションノート
- 第1回 酵素はどんなものか(その1)-1/2
第1回 酵素はどんなものか(その1)-1/2
第1回 酵素はどんなものか(その1) page1
1.酵素の働き
酵素とは「生物の細胞により作られる、触媒の働きを持つたんぱく質である」と定義されます。
今までおおよそ五千から六千種類の酵素が見つけられていますが、
どの酵素でも物質としてみるとたんぱく質の一種です。
たんぱく質は生物の重さの約15%を構成する主要成分ですからどこにでも普通に存在する物質です。
(70%の水分の他、核酸、炭水化物、脂肪が各数%)
酵素としての大切な意義は、その機能として「触媒としての働き」を持っている点にあります。
触媒とは「それ自体は変化せずに反応の進行を速める物質である」と定義されます。
おそらく一度は化学の話の中で聞いたことがあるのではないでしょうか。
触媒としての酵素の作用とはどんな働きでしょう。
酵素の働きを身近な例で見ると洗剤中のリパーゼやプロテアーゼなどの例が挙げられます。
最近の市販の洗剤のほとんどにはプロテアーゼが添加されています。
プロテアーゼはたんぱく質を分解する酵素の総称です。
プロテアーゼの作用はたんぱく質をアミノ酸や、アミノ酸が数個つながった断片(ペプチド)に分解する働きをします。
普通衣服に付着する汚れを成分として見ると、主に汗や食べこぼしの中にある油脂とたんぱく質で、
たんぱく質は繊維の内部にしみこんでしまうと繊維と固く結合・吸着してしまい、洗剤本来の界面活性作用や、
物理的な揉みほぐしだけではなかなか落ちにくくなります。
したがって酵素の働きを借りてたんぱく質の汚れを分解してやれば洗濯がきれいに速く仕上がるというわけですね。
この現象を分子のレベルで表すと、たんぱく質1個が酵素の働きで分解されてn個のペプチドができたことになり、この時n-1個の水が使われます。
![]()
という化学反応式に書くことができます。ペプチドはさらにアミノ酸へと分解されてゆきます。
たんぱく質も水も安定な物質ですので、もちろんそれだけで放置しておいてもペプチドに分解することはありません。
ところがプロテアーゼが来ると室温で数分のうちに分解されてしまうのです。
洗濯するときには風呂の残り湯などぬるま湯を使うとさらに早く分解させることができますね。
プロテアーゼを使わずにたんぱく質を分解するにはどうしたらよいでしょう。
方法はあります。苛性ソーダなどの強アルカリを加えて数時間加熱することが必要になります。
たんぱく質内のペプチド結合は安定な結合なので、これを断ち切るにはペプチド結合の強い結合力に
打ち勝つ過酷な条件が必要なのです。これが強アルカリ(高濃度のOH-イオン)と熱を使う化学的な方法です。
もちろんこんな方法は衣服が傷んでしまうので洗濯には使えません。
逆に言うと、プロテアーゼという酵素を使うことにより、過激で危険な条件を使うことなく、上の反応を進めることができます。
プロテアーゼという酵素の触媒作用を利用することで簡単、短時間に、安全にたんぱく質を分解することができたわけです。
たんぱく質は安定な物質です。
なのにプロテアーゼがあるといとも簡単に分解してしまいます。
またプロテアーゼが存在してもn個のペプチドが結合してたんぱく質へと逆行する(重合する)ことはありません。
なぜでしょうか。ここからは化学の言葉を借りて整理しておきます。
上の反応をさらに単純化して
![]()
と書くことにします。
Aはたんぱく質、Bは水、Cはペプチドです。
熱力学の言葉では:
物質はそれぞれ固有のエネルギーを持っています。
これをグラフで表すと図1のように表せます。
熱力学の言葉では:
物質はそれぞれ固有のエネルギーを持っています。
これをグラフで表すと図1のように表せます。
上の例で言いますと、反応物A+B(たんぱく質+水)の
持つエネルギーは生成物Cペプチド)の持つエネルギー
より高いため、ちょうど水が高いところから低いところへ
流れるように反応が進み、そのエネルギーレベルの差の
分を熱として放出します。
言い換えると、もともと反応は右方向へ
(A+BからCへ、たんぱく質からペプチドへ)
進みたがっています。(図1の鎖線)
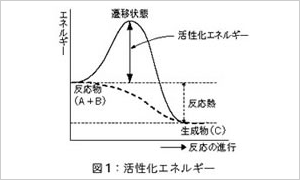
ところが二つの間には山があってそのままでは水は流れません。(反応は進みません)
反応を進めるためにはこのエネルギーの山(=活性化エネルギー)を越えさせる必要があります。
たんぱく質の分子と水の分子がぶつかる力は弱く、活性化エネルギーの山を越えられません。
このため化学法では、アルカリと熱をかけることで活性化エネルギーを与え、
(OH-イオンでペプチド結合を攻撃させ、)活性化エネルギーの山を越えさせているのです。
生成物C(ペプチド)のエネルギーレベルは反応物A+B(たんぱく質+水)の持つエネルギーレベルより低いところにあるため、CからA + B へそのままでは遡れません。遡らせるためにはより大きな活性化エネルギーが必要になります。
これは酵素があるなしにはかかわりません。物質の持つエネルギーはそれぞれに固有ですので、
酵素は物質間のエネルギーレベルの位置関係を変えることはできません。
少し専門的な言葉で言うと酵素は化学平衡に到達する速度を速めるけれども化学平衡そのものを
ずらすわけではありません。
酵素の触媒としての働きとは活性化エネルギーの
山越えをする代わりに図2に示すように、バイパスとして
トンネルを貫通させて水を楽に流してやることに
相当します。
反応物のエネルギーレベルと生成物のエネルギー
レベルの高低を変えることではなく、活性化エネルギー
の障害の高さを下げてやる事にすぎません。
障害を低くすることによってA+BからCへ反応を早く
進ませるという単純なことなのです。
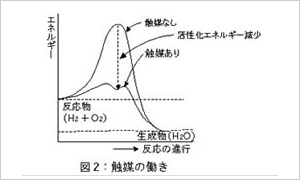
ですからいくら酵素があっても生成物Cから反応物A+Bに逆行させることは、水を溯らせることのようにできません。
(但し厳密にはボルツマン分布による。)
また酵素は触媒ですので、それ自体は反応の過程で消費されることはなく、反応の前後で変化することはありません。
化学反応で使われる触媒
それでは酵素はどのようにして活性化エネルギーを下げることができるのでしょう。
この仕組みを知るためには酵素の分子構造について詳しく知る必要があります。
ひとつ参考になるのは化学反応で使われている(酵素以外の)触媒についてです。
触媒は生産現場でも化学反応工程には必ずといってよいほど使われています。
水素ガス(H2)と酸素ガス(O2)を混ぜ合わせてもそのままでは何も起こりません。
室温では水素分子と酸素分子の衝突する速度が活性化エネルギーの山を越えるほど強くないからです。
しかしこれに火を近づけて熱を与えると分子同士が衝突する速度が上がり、活性化エネルギーの山を越え、
水素と酸素が爆発的に反応して水(2H2O)となり、反応熱を放出(燃える)します。
前のたとえでは、水素ガス(H2)と酸素ガス(O2)はエネルギーのレベルが高く、反応物である水(H2O)のレベルは
低いところにあります。水が低いほうに流れることになります。
![]()
熱を加えなくとも室温のまま白金の細かい粒を加えるとやはりこの反応は進み、水と反応熱を出します。
このとき白金の働きは活性化エネルギーの山にバイパスを通し、室温では進まなかった反応を室温のまま
進行させたのです。白金自体には変化は起こっていないので白金は触媒として働いたのです。
白金はどのようなメカニズムで活性化エネルギーを下げることができるのでしょう。
厳密な証明は難しいのですが次のように考えられています。
-水素ガスの分子(H2)と酸素ガスの分子(O2)は白金粒子の表面に吸着される。
吸着されると白金表面上で水素ガス分子と酸素ガス分子は原子単独のような状態(遷移状態)になると考えられる。
この遷移状態は分子のときよりもずっと不安定で反応を起こしやすい。
つまり活性化されている。
したがって水素原子と酸素原子は次々と反応し、酸素原子1個と水素原子 2個が結合した水分子ができると、
白金触媒の表面から次々と放れてゆく。
-水素分子(H2)内の水素原子間の結合や、酸素分子(O2)内の酸素原子間の結合はもともと安定で、
これらが切れて原子のような状態になることは普通ありえないのですが、白金触媒表面上ではこれが起こるらしいのです。
これが化学触媒の作用のメカニズムです。
触媒の表面上で特別な「遷移状態」を作ることが重要な点です。
そのような遷移状態を経由することで活性化エネルギーの山を低くして(つまり熱をかけずに)通過することが
できるというわけです。
後で触れますが、酵素の触媒作用も基本的には化学触媒と同じで、特別な「遷移状態」を作ることと考えられます。
>> 2.酵素の構造(その1)
執筆者:深見 博一(理学博士)
本書で引用した図表の出典
参考図書-1:「酵素反応のしくみ」、藤本大三郎著、株式会社講談社ブルーバックス、2001.12.1
参考図書-2:「酵素のおはなし」、大島敏久・左右田健次共著、財団法人日本規格協会、1997.11.20
図5:アミノ酸の親水性の度合い:参考図書-1、p.111、図5-5
図6:ウシすい臓由来リボヌクレアーゼの一次構造:参考図書-2 p.38、図2.7
図7:たんぱく質のα-ヘリックス構造:参考図書-1、p.117、図5-9
図8:たんぱく質のβ-構造:参考図書-2、p.40、図2.10
図9:たんぱく質(ミオグロビン)の三次構造:参考図書-2、p.40、図2.11
表1:たんぱく質構成アミノ酸の構造と表示法:参考図書-2、p.27、表2.1
資料ダウンロード
上記の内容をPDFでダウンロードできます。
|