- HOME
- 製品・サービス
- 酵素法による食品分析試薬 F-キット
- F-キットのアプリケーションノート
- 第1回 酵素はどんなものか(その1)-2/2
第1回 酵素はどんなものか(その1)-2/2
第1回 酵素はどんなものか(その1) page2
2.酵素の構造(その1)
アミノ酸とたんぱく質
酵素の本体はたんぱく質です。
したがって酵素もたんぱく質としての共通の性質を持っています。
たんぱく質は多数の種類があり、生物の体の中で
それぞれが多様な働きをしています。
細胞の構造を作り運動をし、ホルモンとしての調節をし、
体の防衛をします。
そのたんぱく質の1つとして酵素があります。
たんぱく質は20種類のL-アミノ酸が鎖のように結合した
高分子化合物です。
アミノ酸は一般式で表すと図3に示す構造の化合物
でどれもカルボキシル基(-COOH)とアミノ基(-NH2)を
持つ点は共通です。
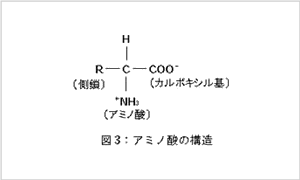
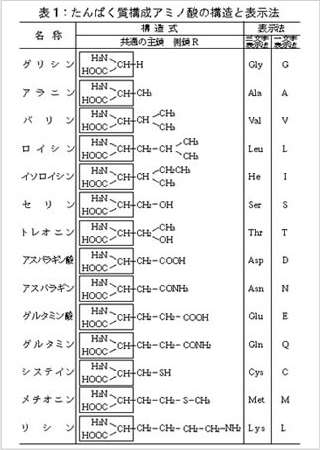
R-の部分(側鎖といいます)の種類により表1に示した20種類があります。
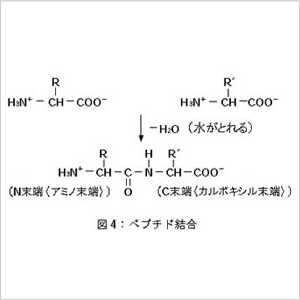
アミノ酸同士はカルボキシル基と隣のアミノ酸のアミノ基
との間で反応して水がとれるような形で結合します。(図4)
この結合をペプチド結合といいます。
つぎつぎにアミノ酸がペプチド結合によりつながり、
長い鎖を作ったものがたんぱく質です。
一本の鎖(ペプチド鎖)を垂らして、その鎖の周りに
アミノ酸の側鎖が突き出したような、ブラシのような形と
なります。
話が少しずれますが、地球上の生物の生命活動の
主要な部分を担っているのがたんぱく質ですが、
そのあらゆるたんぱく質をつくる部品としてのアミノ酸が
20種類しかなく、その20種類の側鎖の構造には必ずしも
統一的な理由が感じられず、思いつきで拾い集めた
ような感じのものであるのは不思議さを感じますね。
もっとも核酸がATGCのたった4種類の部品からできて
いるのを思えば、20種類は充分多いとも言えますが。
それでもここで注意しておかねばならないのは、20種類のアミノ酸の側鎖の性質のうち、
「極性が高いか、低いか」という点です。
アミノ酸の側鎖の「極性が高いか低いか」を別の言葉では「親水性か疎水性か」という言い方もします。
「水になじみやすいか、油になじみやすいか」と同じ意味ですね。
図5にアミノ酸残基の極性の度合いを表に示しました。
水の中では水になじみやすいもの同士が、また油になじみやすいもの同士が、それぞれ集まろうとします。この性質がたんぱく質が高次構造を作るときに重要な役割をします。

酵素たんぱくの一次構造

図6に示したウシのすい臓リボヌクレアーゼの例では、N-末端アミノ酸であるリジンから始まり、
C-末端のアミノ酸のバリンにいたる124個のアミノ酸からなる1 本鎖の構造を持っています。
構成するアミノ酸残基の1 つ分の分子量は平均すると約110なのでリボヌクレアーゼの分子量は約14,000です。
このリボヌクレアーゼは酵素分子としては最も小さな部類に属します。
一般に酵素分子の大きさはまちまちで、分子量5~10万位のものが多いけれども、
中にはグルタミン酸デヒドロゲナーゼの100~200万といった例もあります。
ウシのすい臓リボヌクレアーゼの1例を示しましたが、酵素としてのたんぱく質分子をつくるアミノ酸の数と種類と順序、
つまり配列はその酵素の種類と由来とにより固有です。
その鎖の中のアミノ酸の配列順序を一次構造と呼んでいます。
たんぱく質の高次(二次、三次、四次)構造
図6のリボヌククレアーゼのたんぱく分子の鎖
(ペプチド鎖とも言う)は平面の上に広げたように
描かれていますが、実際の酵素たんぱく分子はが
鎖立体的に折りたたまれることで、多くの場合球状に
なっています。
実はタンパク質分子が立体的な構造をとるということは、
その酵素が働きを示す上で非常に大切なことなのです。
たんぱく質の立体構造を二次構造および三次構造と
呼んでいます。そのうちたんぱく質の鎖の中で局部的に
規則性を示す構造を二次構造といいますが、
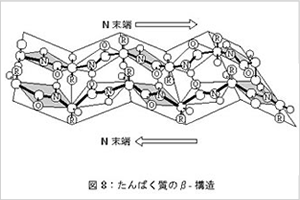
二次構造としてはα-へリックス(図7)と β-構造(図8)
がよく知られています。
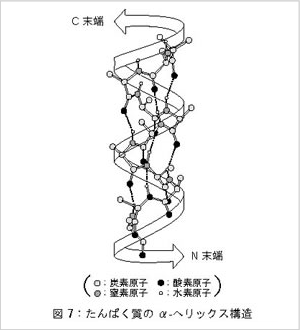
α-へリックスは一本のペプチド鎖がらせんに巻いた筒状の構造です。
この構造は同じペプチド鎖の中の4つ先の(または4つ後の)アミノ酸のC=Oと-NH-との間で形成される
水素結合で安定化されています。
またβ-構造は2本のペプチド鎖が平行に並び、折りたたまれたシート状の繰り返し構造をとっています。
このβ- 構造も2 本のペプチド鎖間の主鎖のC=Oと-NH-との間で作られる水素結合で保持されています。
三次構造は二次構造を含むペプチドの鎖のもっと広い範囲で見られる折りたたみ構造で、
立体的な空間配置のことを言います。
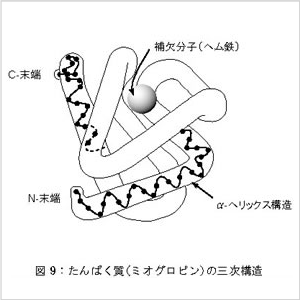
図9はミオグロビン(正確には酵素ではないですが)の
三次構造の例ですが、α- へリックスの筒が何回か
折りたたまれているのがわかります。
三次構造もまた水素結合や疎水結合などで維持
されていると考えられます。
多くの酵素では三次構造をもつ2本以上のペプチド鎖が
集まってさらに高次な構造を作ります。
これを四次構造とよび、構成するペプチド鎖を
サブユニットと呼びます。
たとえば肝臓のアルコール脱水素酵素は2つの同一
のサブユニットからなる2量体構造ですし、
筋肉の乳酸脱水素酵素は4量体構造です。
またグルタミン酸脱水素酵素は6量体構造を基本とし、
それが更に重合して巨大分子を作ります。
酵素分子の立体構造と変性
酵素分子の一次構造、つまりペプチド鎖はアミノ酸同士が共有結合で繋がっていますので安定です。
一方、二次構造、三次構造、四次構造では、共有結合以外の水素結合、イオン結合、疎水結合などに
酵素の失活は熱処理以外でも、酸やアルカリ、尿素などの試薬によっても起こります。
酸やアルカリはイオン結合を切ることによって酵素たんぱくの立体構造をゆるめます。
尿素は分子中の-HN-C=Oといよってペプチド鎖の中やペプチド鎖の間で引き合って、
その総和として立体構造が維持されています。
水素結合は電気陰性度(電子の偏り)の高い二つの原子(ペプチド鎖の中で言えばO原子とN原子)の間で、
電気陰性度の低い(つまり弱い正電荷を持つ)水素原子が仲立ちをすることで引き合う結合です。
疎水結合はたんぱく質が極性の高い水の環境の中に入ると非極性基(または疎水性部分)が水から排除されることで
疎水基同士が引き合う結合です。水素結合も疎水結合もそれ自体が共有結合に比べてずっと弱いため、
結果的に酵素の立体構造も決して強固なものではなくむしろ不安定な物と言えます。
酵素の溶液を熱湯の中で加熱するとほとんどの酵素では数分間で触媒活性が失われてしまいます。
この失活した酵素分子を調べてみるとペプチド鎖の切断は起こっていない、つまり酵素たんぱくの一次構造は
そのままなのに、活性が失われてしまっているのです。
これは酵素たんぱくの鎖の立体構造が熱処理によって変化してしまったためと考えられます。
このように、本来正しく折りたたまれていたたんぱく質の鎖の立体構造が変化してしまうことをたんぱく質の変性といいます。
たんぱく質は多くの場合一度変性すると元通りには戻りません。(不可逆的変性)
酵素たんぱくが変性すると酵素は活性を失い、失活します。
酵素が触媒活性を現わすには、その酵素分子が正しい立体構造を保っていることが絶対に必要なのです。
構造がペプチド鎖の構造(の水素結合を作る部分)と同じであり、ペプチド鎖の作る水素結合を中和してしまうため
と考えられます。
また酵素たんぱくのペプチド鎖中の二つのシステイン残基の-SHからHがとれて-SS-の結合(ジスルフィド結合という)
を作ることがあります。(これは共有結合ですが)
-SS-結合によってペプチド鎖間に橋渡しができ、分子の立体構造(特に三次構造)が維持されることもよく見られます。
図6のウシリボヌクレアーゼの場合ではアミノ酸残基の26番目と84番目、65番目と72番目のシステイン残基間で
それぞれ-SS-結合ができています。
この場合は同一ペプチド鎖内での例ですが、異なるペプチド鎖間で橋渡しができることもあります。
ジスルフィド結合の形成はH原子がとれる反応、つまり酸化反応ですから、還元剤によってもとの-SHに切りもどす
ことができます。リボヌクレアーゼの場合では還元剤によって-SS-結合を切ると触媒活性が失われます。
立体構造をとめていた留め金が外れたようになり、構造が緩んでしまったためと考えられます。
しかし厄介なことに、多くの酵素では-SH 基が近傍の他の-SH基と自発的に酸化反応して架橋を作ってしまい、
そのために逆に酵素活性が失われることが多いのです。
これは予定外の場所に-SS-結合ができることで、立体構造にゆがみや歪みができ、
そのまま留め金でとめられたようになったためと考えられます。
実際に酵素を扱う場合に、ジスレイトールなどの温和な還元剤を加えることが多いのは、
この偶発的な酸化反応を防ぐためです。
>> 3.酵素の構造(その2)
執筆者:深見 博一(理学博士)
本書で引用した図表の出典
参考図書-1:「酵素反応のしくみ」、藤本大三郎著、株式会社講談社ブルーバックス、2001.12.1
参考図書-2:「酵素のおはなし」、大島敏久・左右田健次共著、財団法人日本規格協会、1997.11.20
図5:アミノ酸の親水性の度合い:参考図書-1、p.111、図5-5
図6:ウシすい臓由来リボヌクレアーゼの一次構造:参考図書-2 p.38、図2.7
図7:たんぱく質のα-ヘリックス構造:参考図書-1、p.117、図5-9
図8:たんぱく質のβ-構造:参考図書-2、p.40、図2.10
図9:たんぱく質(ミオグロビン)の三次構造:参考図書-2、p.40、図2.11
表1:たんぱく質構成アミノ酸の構造と表示法:参考図書-2、p.27、表2.1
資料ダウンロード
上記の内容をPDFでダウンロードできます。
|