- HOME
- 製品・サービス
- 酵素法による食品分析試薬 F-キット
- F-キットのアプリケーションノート
- F-キットを用いたD-グルコース/果糖(D-フルクトース)の定量
F-キットを用いたD-グルコース/果糖(D-フルクトース)の定量
生体試料 (動物・植物組織、血液、尿など) 中のグルコースと果糖の定量をします。
また、試料の前処理や単品試薬を追加することでイヌリン、ラクチュロースも定量することができます。
F-キット D-グルコース/果糖(D-フルクトース)概要
キット内容
1.ビン1
:乾燥粉末 約5g
(トリエタノールアミン緩衝液pH7.6、NADP、ATP、硫酸マグネシウムを含む)
2.ビン2
:酵素懸濁液約0.7ml
(HK:ヘキソキナーゼ、G6PDH:グルコース-6-燐酸脱水素酵素)
3.ビン3
:酵素懸濁液約0.7ml
(PGI : 燐酸化グルコースイソメラーゼ)
添付:コントロール用グルコース標準液(非必須試薬)
測定原理
酵素法(G6PDH-HK法)
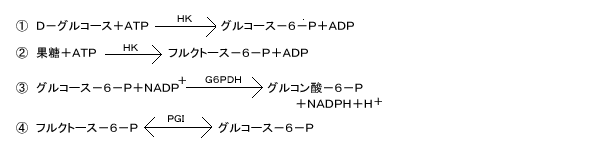
①と③により、グルコースと同モル生成した NADPHを340nmで吸光度測定します。
(NADPは340nmで吸光度がありません。)
果糖定量は④の反応を追加して増加吸光度を測定します。
吸光度の測定は、グルコースと果糖それぞれの酵素反応が開始する前と終了(吸光度が一定となる)した後で行います。
その吸光度差から検体の濃度を算出します。
下記のタイムコースを参照下さい。
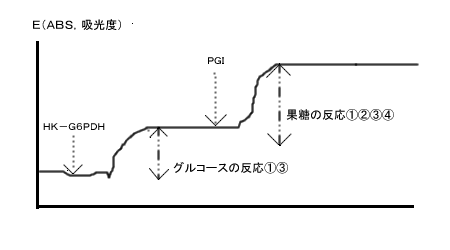
F-キットD-グルコース/果糖のタイムコース
特異性、検出限界、正確性
- 【 特異性 】
ヘキソキナーゼ(HK)とグルコース-6-リン酸脱水素酵素(G6PDH)、
リン酸化グルコースイソメラーゼ(PGI)を使用した本法は、
D-グルコースと果糖 (D-フルクトース)のみを定量(特異的に反応)します。 - 【 直線性 】
測定の直線性は、
約1μg D-グルコース+D-フルクトース/アッセイ
(0.4mg D-グルコース+D-フルクトース/検体濃度、使用検体量2ml)
から
100μg D-グルコース+D-フルクトース/アッセイ
(1g D-グルコース+D-フルクトース/検体濃度、使用検体量0.1ml)
の間にあります。 - 【 感度と測定限界 】
測定感度:
1キュベット反応で使用する検体量が2.0mlの時0.005の吸光度差を与える検体濃度を基にしています。
波長340nmで測定した際の感度は0.2mg/L検体です。
測定限界:
1キュベット反応で使用する検体量が2.0mlの時0.010の吸光度差を与える検体濃度を基にしています。
波長340nmで測定した際の測定最低限界は0.4mg/L検体です。
試薬、測定機器に従って高濃度の試料は蒸留水で希釈して使用して下さい。 - 【 正確性 】
試料の二重測定した場合、 0.005~0.010の吸光度差が生じることがあります。
(定量操作誤差による)標準偏差は指定濃度範囲内で約1~2%です。
| 血液中のグルコース | CV = 1.2~1.8% |
|---|---|
| チョコレート中の果糖 | CV = 1.5% |
| ダイエットビール中のグルコース | x = 1.0g/100ml |
| r = 0.030g/100ml | S(r)= ±0.011g/100ml |
| 全卵(液状)中の果糖 | x = 6.72g/100g |
| r = 0.587g/100g | S(r)= ±0.207g/100g |
| R = 0.748g/100g | S(R)= ±0.264g/100g |
測定検体の濃度算出
吸光度変化量(ΔE)
グルコース又は果糖が反応して、同モルのNADPHが生成したことによる吸光度増加分を求めます。
ΔE(グルコース)= 検体(E2-E1)-ブランク(E2-E1)
Δ E(果糖)= 検体(E3-E2)-ブランク(E3-E2)
分子吸光係数より濃度計算
吸光度とモル濃度が比例関係にあり、 NADPHの分子吸光係数が機知であるので、標準物質不使用で濃度算出できます。
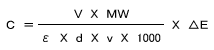
C:濃度(g/L) ε:分子吸光係数(1×mmol-1×cm-1) V:反応液量(ml)
v:検体量(ml) MW:分子量 d:光路長(cm)
以上より測定波長 340nmでのグルコース、果糖それぞれの定量ファクター(F)が求められます。
C(g/L)=F×ΔE
D-グルコース/果糖(D-フルクトース)の定量操作方法
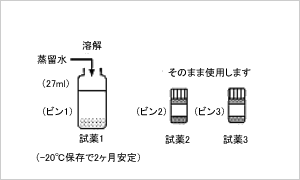
(1)試薬の調整
- メスシリンダーまたはピッペトなどを用い、
ビン1に蒸留水27mlを加えます。
栓をして泡立ないように緩やかに溶解し、
試薬が安定するまで約15分間放置します。
ビン2、ビン3の酵素懸濁液が均一になるように
泡立てないように振盪し、
(例:栓をして倒しローリングする)
そのまま使用します。

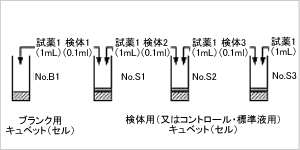
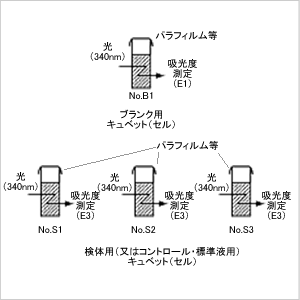
(2)ピペッテイングと吸光度測定 ステップ1
- 試薬1(ビン1溶解液)1ml、をサンプル用キュベット
とブランク用キュベット各々にピペッター、
またはピペットで分注します。
検体0.1mlをサンプル用キュベットにピペッター、
またはピペットで正確に加えます。

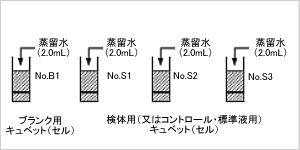
ステップ2
- サンプル用キュベットには蒸留水1.9ml、
ブランク用キュベットには蒸留水2.0mlをピペッター、
ピペットまたはディスペンサー等で加えます。
サンプル量の増減がある場合は、
その増減分を蒸留水で補充してください。

ステップ3
- 穏やかに混和(例:パラフイルム等でキュベット
の口を覆い泡立てないように倒置攪拌、または、
攪拌棒(Cat.No.19623)で穏やかに攪拌) し、
試薬等の均一化に約3分間放置させます。
分光光度計で各キュベットを吸光度測定(E1)します。

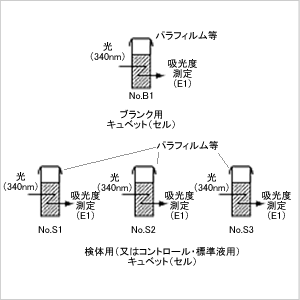
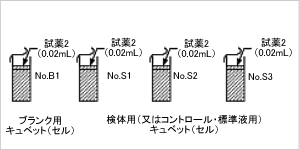
ステップ4
- 試薬2(酵素懸濁液、ビン2)0.02mlをピペッター
で攪拌棒のへたの上に落とし、各キュベットに
攪拌棒を入れます。
(別法:試薬2、0.02mlをキュベットを覆った
パラフィルムを少し開けてピペッターで加えます。)

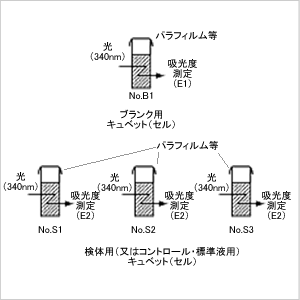
ステップ5
- ステップ3と同様にして穏やかに混和し、
約10~15分間室温放置(20~25℃で酵素反応)
します。
分光光度計で各キュベットを吸光度測定(E2)
します。
・・・・・・・・・グルコースの測定

ステップ6
- ステップ4と同様にして、試薬3(酵素懸濁液、ビン3)
0.02mlを各キュベットに加えます。

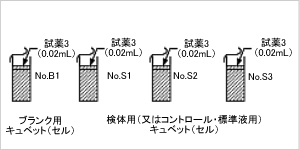
ステップ7
- ステップ3と同様にして穏やかに混和します。
混和後約10~15分間室温放置(20~25℃で酵素反応)
します。
分光光度計で各キュベットを吸光度測定(E3)します。
・・・・・・・・・・・・・・果糖の測定


資料ダウンロード
上記の内容をPDFでダウンロードできます。